Дигидроксилирование — один из важных процессов в превращениях органических веществ, заключающийся в присоединении двух гидроксигрупп к алкену:

В рамках статьи рассмотрено две именных реакции, заключающие в себе такое превращение: по Прево и по Вудворду. Обе реакции представляют собой дигидроксилирование, однако в случае реакции Вудворда происходит син-дигидроксилирование, а в случае Прево — анти-дигидроксилирование.
Син-дигидроксилирование по Вудворду
Для того чтобы провести дигидроксилирование по Вудворду, к алкену (рассмотрен транс-алкен) добавляют иод I2 и ацетат серебра CH3COOAg в среде уксусной кислоты. На первой стадии молекула иода I-I гетеролитически распадается на катион I+, который входит в состав органической молекулы, и анион I—, который выпадает в осадок с катионом серебра в виде нерастворимого AgI. В свою очередь, катион иода, присоединяясь к алкену, образует иодониевый катион:

Стереохимия соединения сохраняется при переходе от реагента (алкена) к данному продукту: один заместитель направлен перпендикулярно плоскости рисунка в одну сторону, а второй — в другую.
Однако, в растворе от изначального ацетата серебра остаётся ацетат-ион, который атакует по иодониевому катиону и раскрывает малый цикл:

Можно заметить, что в полученной молекуле присутствует как атакующая частица-нуклеофил (атом кислорода ацетатной группы), так и хорошая уходящая группа (нуклеофуг) — атом иода. Поэтому возможна реакция нуклеофильного замещения по механизму SN2, которая идёт внутримолекулярно:

Полученное соединение имеет три резонансных формы, но из-за высокой электроотрицательности кислорода положительный заряд в основном находится на атоме углерода и соединение представляет собой карбокатион:

Однако карбокатионы в водной среде неустойчивы, и молекула воды присоединяется к нему, донируя электронную пару атома кислорода:

В результате присоединения получается циклический ацеталь. В кислой среде ацетали тоже неустойчивы и цикл раскрывается:

Дальше смесь обрабатывают раствором щелочи для гидролиза сложного эфира (ацетата):
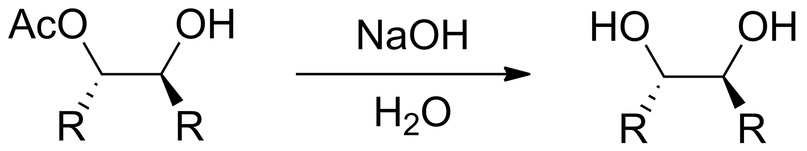
В результате получается продукт дигидроксилирования алкена, то есть присоединения двух OH-групп к соседним атомам углерода, ранее связанных двойной связью C=C.
При этом произошло син-присоединение, что означает присоединение двух OH-групп «с одной стороны» к изначальной молекуле алкена.

Анти-дигидроксилирование по Прево
Для синтеза по Прево используют не водную среду, а неполярную органическую, часто — бензол. Вместо ацетата серебра берут соль с более стерически затруднённым анионом — бензоат серебра.
Синтез начинается аналогично: к алкену добавляется иод, но теперь уже вместе с бензоатом серебра. Образуется иодониевый катион, который раскрывается бензоат-анионом:
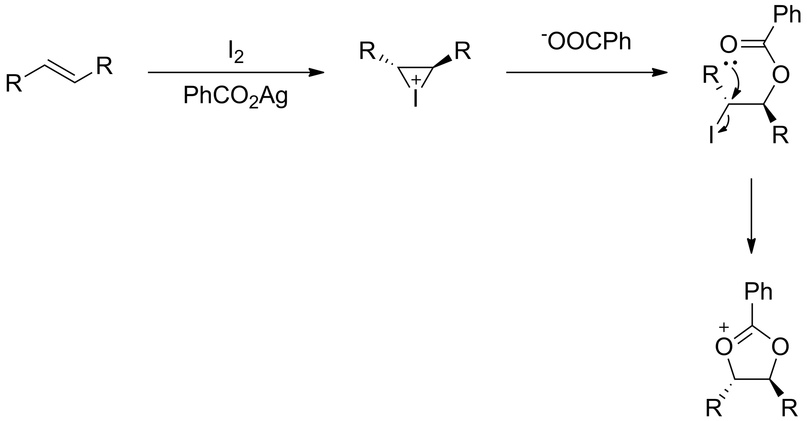
На стадии образования циклического сложного эфира, нужно обратить внимание на то, что в смеси нет воды, которая могла бы раскрыть цикл так же, как и в прошлом случае (в реакции Вудворда), поэтому становится возможна атака анионом бензоата — реакция нуклеофильного замещения SN2:

На рисунке Bz- обозначает бензоил (PhCO-). Так как реакция атаки является нуклеофильным замещением, то она происходит с другой стороны относительно того атома, который замещается (в данном случае атом кислорода, левый на рисунке). Поэтому именно на этой стадии меняется стереохимия вещества.
Уже после всех этих стадий добавляют щёлочь для гидролиза сложных эфиров и образуется диол (можно заметить, что проведение данной реакции в этой среде приводит к образованию того же диола, что и эпоксидирование алкенов с последующим гидролизом).
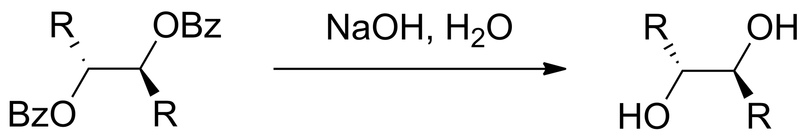
Проекция Фишера выглядит следующим образом:

Здесь наглядно можно видеть, что прошёл процесс анти-присоединения (присоединения с разных сторон относительно изначальной двойной связи) гидроксигрупп и проекция Фишера говорит об эритро-конфигурации конечного продукта.
Любите химию!
