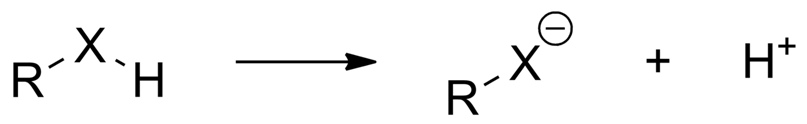
Из общей химии известно, что, согласно теории Бренстеда-Лоури соединение считается кислотой, если оно способно отдавать катион водорода — протон:
$$\ce{HA <=>H^+ + A^-}$$
В данной статье разобрано несколько типов кислотных групп в органической химии, наиболее часто встречающихся в молекулах органических соединений.
При диссоциации в каком-либо растворителе (чаще всего — воде) кислота отщепляет катион водорода в данный растворитель. При этом считается, что чем проще кислота отрывает от своей молекулы этот протон, тем сильнее эта кислота:
Отсюда следует, что чем стабильнее образующийся анион \(\ce{R-X^-}\), тем выгоднее отрыв протона, а значит — тем сильнее эта кислота \(\ce{R-XH}\).
I тип. Электроотрицательность
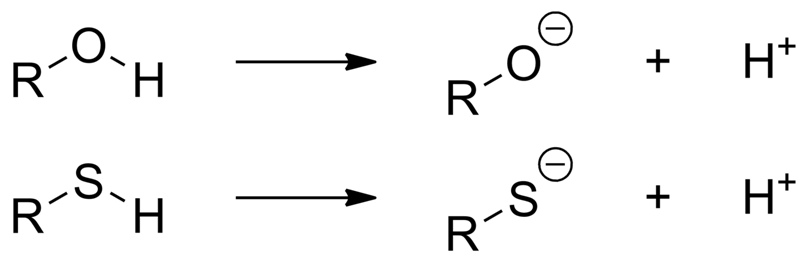
Самые часто встречающиеся примеры кислотных групп — такие группы, где водород присоединён к атому кислорода, серы, селена, азота, фосфора — достаточно электроотрицательным атомам:
И в данном случае стабилизация анионной частицы достигается за счёт сильной электроотрицательности этих гетероатомов и их способности удерживать отрицательный заряд.
Второй тип. Стабизирование кетоном
В этом типе «минус» возникает на α-атоме углерода у некой кетогруппы (может быть кетонная C=O, может быть иминная C=NR’).
За счёт этой кетогруппы и явления делокализации отрицательный заряд стабилизирован, и находится в большей степени на самом электроотрицательном атоме:
Кстати, вместо кетогруппы также можно рассматривать нитрогруппу:
Третий тип. Стабилизация элементом старшего периода
В соединении вида R–X–C–H, где X — элемент старших (3-го и более) периодов (например, P, S, Cl, Se, Br, I) отрицательный заряд на углероде, если он возникает, стабилизирован за счёт пустых d-электронных подуровней, по которым этот заряд делокализуется.
Четвёртый тип. Терминальные ацетилены
Ещё со школы мы знаем, что соединения с терминальной (находящейся на «хвосте» молекулы) тройной связью C-C (алкины) обладают кислотными свойствами за счёт sp-гибридизации атома углерода (в отличие от алканов (sp3) и алкенов (sp2), у алкинов кислотность более выражена из-за бóльшего удерживания электронной плотности на sp-гибридной орбитали, обладающей бóльшим s-характером):
Пятый тип. Ароматика
У некоторых соединений, в частности циклопентадиена, кислым оказывается атом водорода, находящийся симметрично относительно двух двойных связей (см. рисунок), и при отщеплении протона в этом месте образуется анион, за которым возникает ароматичность молекулы, за счёт которой отрицательный заряд стабилизируется:
Любите химию!